
選択的抗トロンビン剤 「ノバスタン」を適正にご使用いただくために、治療の際におこり得る重要な副作用等の安全性ならびに有効性に関わる情報を、医療関係者の医療関係者の皆さまに向けてご紹介します。
ノバスタン®HIT全例調査の概要
ノバスタン® HI注10mg/2mL 使用成績調査(全例調査)の概要
<ヘパリン起因性血小板減少症(HIT)Ⅱ型における血栓症の発症抑制>
| 目的 |
|
||||
|---|---|---|---|---|---|
| 対象患者 | HITⅡ型における血栓症の発症抑制に本剤が使用された患者 | ||||
| 用法・用量 | 添付文書の用法用量に従い、適正にご使用願います。 | ||||
| 調査方法 | 中央登録方式、レトロスペクティブ
|
||||
| 調査項目 (抜粋) |
|
||||
| 調査期間 | 調査期間:2008年7月16日~2017年7月31日 登録期間:2008年7月16日~2017年6月30日 |
||||
| 予定症例数 | 可能な限り全例 | ||||
| 標準観察期間 | 本剤投与開始から投与終了後30日 |
<ヘパリン起因性血小板減少症(HIT)Ⅱ型患者における血液体外循環時の灌流血液の凝固防止(血液透析)>
| 目的 |
|
||||
|---|---|---|---|---|---|
| 対象患者 | HITⅡ型における血液体外循環時の灌流血液の凝固防止を目的に本剤が使用された患者 | ||||
| 用法・用量 | 添付文書の用法用量に従い、適正にご使用願います。 | ||||
| 調査方法 | 中央登録方式、レトロスペクティブ
|
||||
| 調査項目 (抜粋) |
|
||||
| 調査期間 | 調査期間:2011年5月20日~2017年7月31日 登録期間:2011年5月20日~2017年1月31日 |
||||
| 予定症例数 | 300例以上(安全性評価対象症例数) | ||||
| 標準観察期間 | 本剤投与開始から投与中止または終了まで、ただし、最大6ヵ月 |
<ヘパリン起因性血小板減少症(HIT)Ⅱ型(発症リスクのある場合を含む)における経皮的冠インターベンション施行時の血液の凝固防止>
| 目的 |
|
||||
|---|---|---|---|---|---|
| 対象患者 | HITⅡ型におけるPCI施行時の血液の凝固防止を目的に本剤が使用された患者 | ||||
| 用法・用量 | 添付文書の用法用量に従い、適正にご使用願います。 | ||||
| 調査方法 | 中央登録方式、レトロスペクティブ
|
||||
| 調査項目 (抜粋) |
|
||||
| 調査期間 | 調査期間:2011年5月20日~2017年7月31日 登録期間:2011年5月20日~2017年6月30日 |
||||
| 予定症例数 | 可能な限り全例 | ||||
| 標準観察期間 | 本剤投与開始から投与終了後30日 |
ヘパリン起因性血小板減少症(HIT*:heparin-induced thrombocytopenia)
HITは、発症頻度は極めて低いですが、治療でヘパリンが投与される全ての患者さんで致死性の血栓塞栓症を合併する恐れがある重大なヘパリンの副作用です。
HITは、非免疫学的機序で発症するⅠ型HITと、ヘパリン依存性の自己抗体が出現するⅡ型HITに分類されています。最近の知見ではⅠ型は臨床的な意義をほとんど持たないために、HITの用語はⅡ型を意味するものとして用いられます。
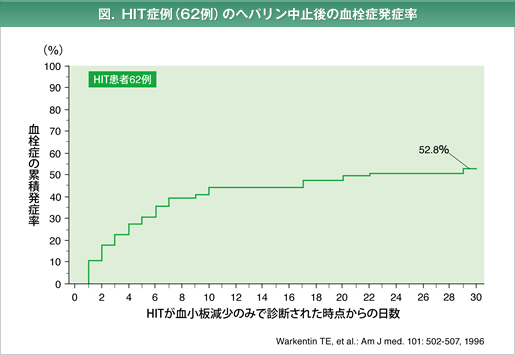
*:HITは、非免疫学的機序で発症するⅠ型HITと、ヘパリン依存性の自己抗体が出現するⅡ型HITに分類される。
最近の知見ではⅠ型は臨床的な意義をほとんど持たないために、HITの用語はⅡ型を意味するものとして用いられる。







