
VMAT2阻害剤 -遅発性ジスキネジア治療剤- 「ジスバルⓇカプセル40mg」を適正にご使用いただくために、治療の際におこり得る副作用等の安全性に関わる情報を、医療関係者の皆さまに向けてご紹介します。
副作用
本剤のリスクにつきまして、最新の電子化された添付文書、適正使用ガイドをよくご確認頂き、
患者様へ十分な情報提供を行った上で処方してください。
市販後の副作用発現状況
► 副作用発現状況(PDF 796KB)
2025年8月29日掲載
発売(2022年6月1日)以降に収集された副作用の一覧です。
- ・本情報は現在調査中の症例情報も含むため、今後の追加情報により内容の変更が生じる場合があることを、あらかじめご了承ください。
- ・1症例に複数の副作用が発現した場合、総計欄の例数は、重篤例と非重篤例の合計例数と一致しないことがあります。
► 市販直後調査:最終結果報告(PDF 667KB)
2023年4月3日掲載
市販直後調査[6ヵ月](発売~2022年11月30日)の報告です。
- ・本情報は現在調査中の症例情報も含むため、今後の追加情報により内容の変更が生じる場合があることを、あらかじめご了承ください。
- ・1症例に複数の副作用が発現した場合、総計欄の例数は、重篤例と非重篤例の合計例数と一致しないことがあります。
► 特定使用成績調査:中間集計(PDF 317KB)
2024年10月31日掲載
2023年1月16日~2024年4月10日までに収集した調査票の報告です。
治験成績(国内臨床試験)
遅発性ジスキネジア患者を対象とした国内第Ⅱ/Ⅲ相試験における副作用(臨床検査値の異常を含む)は、二重盲検期では総症例数169例中74例(43.8%)、長期投与期では総症例数249例中156例(62.7%)、後観察期では総症例数117例中4例(3.4%)に認められました。なお、長期投与期は、二重盲検期又は継続投与期に本剤が1回でも投与された被験者を対象としています。
- 遅発性ジスキネジア患者を対象とした国内第Ⅱ/Ⅲ相試験の試験方法
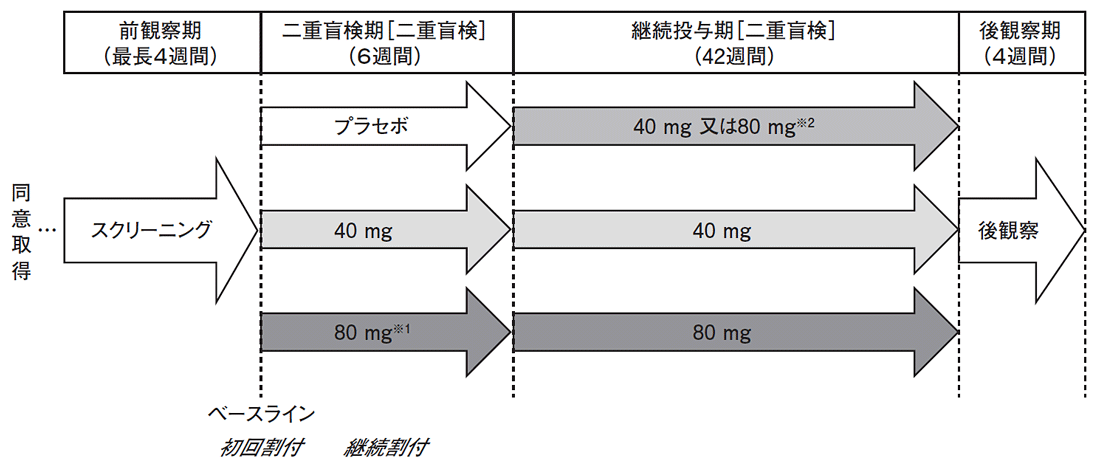
- ※1:二重盲検期に80mg群に割付られた埸合、二重盲検期の投与1~7日目は40mg/日投与とする。
- ※2:二重盲検期にプラセボ群、かつ継続投与期に80mg群に割付られた埸合、継続投与期の投与1~7日目は40mg/日投与とする。
二重盲検期
| 40mg 投与 | 80mg 投与 | 計 | |
|---|---|---|---|
| 対象症例数 | 85 | 84 | 169 |
| 副作用の発現症例数 (%) |
28 (32.9) |
46 (54.8) |
74 (43.8) |
| 副作用の種類※ | 発現例数 (%) |
||
|---|---|---|---|
| 40mg 投与 | 80mg 投与 | 計 | |
| 代謝および栄養障害 | 1 (1.2) |
2 (2.4) |
3 (1.8) |
| 食欲減退 | 1 (1.2) |
2 (2.4) |
3 (1.8) |
| 精神障害 | 4 (4.7) |
2 (2.4) |
6 (3.6) |
| 統合失調症 | 2 (2.4) |
0 (0.0) |
2 (1.2) |
| うつ病 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 脱抑制 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 軽躁 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 落ち着きのなさ | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 自殺企図 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 神経系障害 | 14 (16.5) |
32 (38.1) |
46 (27.2) |
| 傾眠 | 9 (10.6) |
20 (23.8) |
29 (17.2) |
| アカシジア | 4 (4.7) |
4 (4.8) |
8 (4.7) |
| 振戦 | 0 (0.0) |
5 (6.0) |
5 (3.0) |
| 錐体外路障害 | 0 (0.0) |
2 (2.4) |
2 (1.2) |
| パーキンソニズム | 1 (1.2) |
1 (1.2) |
2 (1.2) |
| 浮動性めまい | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| よだれ | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 構語障害 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 頭痛 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 感覚鈍麻 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 痙攣発作 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 表情減少 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 眼障害 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 眼瞼下垂 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 耳および迷路障害 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 感音性難聴 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 呼吸器、胸郭および縦隔障害 | 0 (0.0) |
2 (2.4) |
2 (1.2) |
| 呼吸困難 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 咳払い | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 胃腸障害 | 4 (4.7) |
13 (15.5) |
17 (10.1) |
| 流涎過多 | 2 (2.4) |
8 (9.5) |
10 (5.9) |
| 悪心 | 0 (0.0) |
3 (3.6) |
3 (1.8) |
| 便秘 | 2 (2.4) |
0 (0.0) |
2 (1.2) |
| 口内乾燥 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 嚥下障害 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 胃炎 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 肝胆道系障害 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 肝機能異常 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 皮膚および皮下組織障害 | 2 (2.4) |
3 (3.6) |
5 (3.0) |
| 水疱 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 湿疹 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 発疹 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 紅斑性皮疹 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 蕁麻疹 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 筋骨格系および結合組織障害 | 2 (2.4) |
0 (0.0) |
2 (1.2) |
| 背部痛 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 姿勢異常 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 筋痙縮 | 0 (0.0) |
0 (0.0) |
0 (0.0) |
| 一般・全身障害および投与部位の状態 | 8 (9.4) |
7 (8.3) |
15 (8.9) |
| 倦怠感 | 5 (5.9) |
3 (3.6) |
8 (4.7) |
| 疲労 | 0 (0.0) |
2 (2.4) |
2 (1.2) |
| 口渇 | 2 (2.4) |
0 (0.0) |
2 (1.2) |
| 無力症 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 不快感 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 末梢性浮腫 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 臨床検査 | 1 (1.2) |
2 (2.4) |
3 (1.8) |
| 血中クレアチンホスホキナーゼ増加 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| γ−グルタミルトランスフェラーゼ増加 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 体重増加 | 0 (0.0) |
1 (1.2) |
1 (0.6) |
| 傷害、中毒および処置合併症 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
| 鎮静合併症 | 1 (1.2) |
0 (0.0) |
1 (0.6) |
※副作用の分類名、副作用名は、MedDRA/J ver.23.0 の器官別大分類、基本語を用いて表示。
長期投与期
| 40mg 投与 | 80mg 投与 | 計 | |
|---|---|---|---|
| 対象症例数 | 126 | 123 | 249 |
| 副作用の発現症例数 (%) |
64 (50.8) |
92 (74.8) |
156 (62.7) |
| 副作用の種類※ | 発現例数 (%) |
||
|---|---|---|---|
| 40mg 投与 | 80mg 投与 | 計 | |
| 感染症および寄生虫症 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 乳腺炎 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 扁桃炎 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 代謝および栄養障害 | 7 (5.6) |
4 (3.3) |
11 (4.4) |
| 食欲減退 | 2 (1.6) |
3 (2.4) |
5 (2.0) |
| 食欲亢進 | 2 (1.6) |
0 (0.0) |
2 (0.8) |
| 糖尿病 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 高尿酸血症 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 低カリウム血症 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 脂質異常症 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 精神障害 | 13 (10.3) |
18 (14.6) |
31 (12.4) |
| うつ病 | 3 (2.4) |
3 (2.4) |
6 (2.4) |
| 不眠症 | 2 (1.6) |
3 (2.4) |
5 (2.0) |
| 統合失調症 | 2 (1.6) |
3 (2.4) |
5 (2.0) |
| 不安 | 1 (0.8) |
2 (1.6) |
3 (1.2) |
| 感情の平板化 | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 中期不眠症 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 落ち着きのなさ | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 激越 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 歯ぎしり | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 脱抑制 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 軽躁 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 自殺念慮 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 自殺企図 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 無為 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 双極性障害 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 大うつ病 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 異常行動 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 神経系障害 | 37 (29.4) |
58 (47.2) |
95 (38.2) |
| 傾眠 | 16 (12.7) |
26 (21.1) |
42 (16.9) |
| 振戦 | 4 (3.2) |
14 (11.4) |
18 (7.2) |
| アカシジア | 7 (5.6) |
10 (8.1) |
17 (6.8) |
| 浮動性めまい | 3 (2.4) |
4 (3.3) |
7 (2.8) |
| パーキンソニズム | 4 (3.2) |
2 (1.6) |
6 (2.4) |
| 錐体外路障害 | 1 (0.8) |
4 (3.3) |
5 (2.0) |
| よだれ | 1 (0.8) |
3 (2.4) |
4 (1.6) |
| 運動緩慢 | 1 (0.8) |
2 (1.6) |
3 (1.2) |
| ジスキネジア | 2 (1.6) |
1 (0.8) |
3 (1.2) |
| 頭痛 | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 感覚鈍麻 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 遅発性ジスキネジア | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 協調運動異常 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 注意力障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 構語障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| ジストニア | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 意識消失 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 運動障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 鎮静 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 痙攣発作 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 昏迷 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 認知障害 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 表情減少 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 眼障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 眼瞼下垂 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 耳および迷路障害 | 1 (0.8) |
2 (1.6) |
3 (1.2) |
| 感音性難聴 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 耳鳴 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 回転性めまい | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 心臓障害 | 1 (0.8) |
2 (1.6) |
3 (1.2) |
| 徐脈 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 動悸 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 心室性期外収縮 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 血管障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 低血圧 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 呼吸器、胸郭および縦隔障害 | 1 (0.8) |
3 (2.4) |
4 (1.6) |
| 呼吸困難 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 口腔咽頭痛 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 咳払い | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 胃腸障害 | 14 (11.1) |
29 (23.6) |
43 (17.3) |
| 流涎過多 | 6 (4.8) |
18 (14.6) |
24 (9.6) |
| 便秘 | 4 (3.2) |
1 (0.8) |
5 (2.0) |
| 嚥下障害 | 2 (1.6) |
3 (2.4) |
5 (2.0) |
| 悪心 | 0 (0.0) |
4 (3.3) |
4 (1.6) |
| 腹部不快感 | 2 (1.6) |
0 (0.0) |
2 (0.8) |
| 下痢 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 口内乾燥 | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 胃炎 | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 腹部膨満 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 口の感覚鈍麻 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 肝胆道系障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 肝機能異常 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 皮膚および皮下組織障害 | 3 (2.4) |
5 (4.1) |
8 (3.2) |
| 発疹 | 1 (0.8) |
2 (1.6) |
3 (1.2) |
| 水疱 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 湿疹 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 紅斑性皮疹 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 蕁麻疹 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 中毒性皮疹 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 筋骨格系および結合組織障害 | 5 (4.0) |
3 (2.4) |
8 (3.2) |
| 筋力低下 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 姿勢異常 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 背部痛 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 筋固縮 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 四肢痛 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 横紋筋融解症 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 筋骨格硬直 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 腎および尿路障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 排尿困難 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 生殖系および乳房障害 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 乳汁漏出症 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 不規則月経 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 一般・全身障害および投与部位の状態 | 15 (11.9) |
19 (15.4) |
34 (13.7) |
| 倦怠感 | 9 (7.1) |
9 (7.3) |
18 (7.2) |
| 疲労 | 1 (0.8) |
4 (3.3) |
5 (2.0) |
| 口渇 | 2 (1.6) |
2 (1.6) |
4 (1.6) |
| 無力症 | 0 (0.0) |
2 (1.6) |
2 (0.8) |
| 死亡 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 活動性低下 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 不快感 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 異常感 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 歩行障害 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 末梢性浮腫 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 突進性歩行 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 臨床検査 | 8 (6.3) |
5 (4.1) |
13 (5.2) |
| 体重増加 | 3 (2.4) |
3 (2.4) |
6 (2.4) |
| 体重減少 | 3 (2.4) |
1 (0.8) |
4 (1.6) |
| 肝機能検査値上昇 | 2 (1.6) |
0 (0.0) |
2 (0.8) |
| 血中クレアチンホスホキナーゼ増加 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| γ−グルタミルトランスフェラーゼ増加 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
| 尿中ブドウ糖陽性 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 傷害、中毒および処置合併症 | 2 (1.6) |
3 (2.4) |
5 (2.0) |
| 鎮静合併症 | 1 (0.8) |
1 (0.8) |
2 (0.8) |
| 転倒 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 挫傷 | 0 (0.0) |
1 (0.8) |
1 (0.4) |
| 皮膚擦過傷 | 1 (0.8) |
0 (0.0) |
1 (0.4) |
※副作用の分類名、副作用名は、MedDRA/J ver.23.0 の器官別大分類、基本語を用いて表示。
後観察期
| 40mg 投与 | 80mg 投与 | 計 | |
|---|---|---|---|
| 対象症例数 | 67 | 50 | 117 |
| 副作用の発現症例数 (%) |
0 (0.0) |
4 (8.0) |
4 (3.4) |
| 副作用の種類※ | 発現例数 (%) |
||
|---|---|---|---|
| 40mg 投与 | 80mg 投与 | 計 | |
| 精神障害 | 0 (0.0) |
1 (2.0) |
1 (0.9) |
| 統合失調症 | 0 (0.0) |
1 (2.0) |
1 (0.9) |
| 神経系障害 | 0 (0.0) |
3 (6.0) |
3 (2.6) |
| ジスキネジア | 0 (0.0) |
2 (4.0) |
2 (1.7) |
| てんかん重積状態 | 0 (0.0) |
1 (2.0) |
1 (0.9) |
| 一般・全身障害および投与部位の状態 | 0 (0.0) |
1 (2.0) |
1 (0.9) |
| 薬剤離脱症候群 | 0 (0.0) |
1 (2.0) |
1 (0.9) |
※副作用の分類名、副作用名は、MedDRA/J ver.23.0 の器官別大分類、基本語を用いて表示。
本剤のリスクにつきまして、最新の電子化された添付文書、適正使用ガイドをよくご確認頂き、
患者様へ十分な情報提供を行った上で処方してください。








